Anemia falciforme: o cenário do tratamento e as perspectivas (genéticas)
Técnicas de edição genética podem se juntar aos medicamentos e intervenções já disponíveis contra essa doença especialmente comum no Brasil

A anemia falciforme é especialmente incidente no Brasil: afeta entre 60 mil e 100 mil pessoas, de acordo com o Ministério da Saúde. Isso porque é mais comum em pessoas negras, devido a uma combinação de fatores genético. Mas a boa nova é que essa doença genética, com sintomas possivelmente graves (como dores intensas) e que encurtam a expectativa de vida, está passando por avanços significativos no seu tratamento, principalmente com base em uma técnica de edição genética conhecida como CRISPR.
Nas últimas semanas, medicamentos com base nesse método receberam sinal verde de agências de saúde reguladoras do Reino Unido e dos Estados Unidos. Mas por aqui, onde essa tecnologia ainda não está disponível, permanecem desafios no enfrentamento do problema.
Como está o cenário da anemia falciforme no Brasil? O que ela é e quais seus sintomas? E o que podemos esperar do futuro? Confira nessa especial de VEJA SAÚDE sobre o assunto.
+ Leia também: Doença falciforme: informação para atenuar a dor
Quão comum essa doença é no Brasil?
No país, Bahia, Maranhão e Acre são os estados de maior incidência. Entre 2014 e 2022, o Brasil registrou uma média anual de 1 092 novos casos, diagnosticados através do Programa Nacional de Triagem Neonatal. A incidência foi de 4,39 a cada 10 mil nascidos vivos.
Um dado marcante: entre 2014 e 2019, a maior parte dos pacientes morreu na segunda década de vida, de acordo com indicadores do Sistema de Informações de Mortalidade do Sistema Único de Saúde (SUS). Um estudo publicado no periódico Blood Advances revela que, entre brasileiros, a condição reduz a sobrevida em 37 anos.
Entre 2018 a 2022, 2 358 pessoas faleceram em consequência da doença. É registrado mais de um óbito por dia (e um por semana entre crianças de 0 a 5 anos).
O que é anemia falciforme
Ela é marcada por uma deformação nos glóbulos vermelhos do sangue. Essas células, também chamadas de hemácias, são responsáveis principalmente pelo transporte de oxigênio no organismo.
Quando saudáveis, elas apresentam aspecto arredondado. Já nos pacientes com anemia falciforme, assumem forma semelhante a uma meia-lua ou uma foice.
Com esse formato incomum, os glóbulos restringem o fluxo de sangue nos vasos e limitam o fornecimento de oxigênio aos tecidos do corpo, o que uma série de sintomas e danos aos órgãos.
Além disso, as células sanguíneas afetadas pela doença tendem a se destruir de maneira acelerada. Em média, uma hemácia normal dura 120 dias, enquanto as falciformes permanecem no organismo por cerca de 15 dias. Com isso, os pacientes apresentam uma anemia crônica.
Doença genética
Dentro dos glóbulos vermelhos, existe uma proteína associada à função do transporte de oxigênio, a hemoglobina. Acontece que certas alterações genéticas podem alterar a forma dessa proteína ou comprometer sua produção.
No caso da doença falciforme, como você já sabe, acontece uma deformação da hemoglobina – e ela é provocada por uma mutação no gene que codifica uma parte dessa proteína.
Aí, em vez de produzir uma hemoglobina saudável (chamada de hemoglobina A), a célula gera uma versão mutante (hemoglobina S).
As alterações genéticas por trás desse problema passam dos pais para o filho. Detalhe: para ter anemia falciforme, a pessoa precisa receber versões mutadas dos genes dos dois pais. Se recebe de apenas um deles, o indivíduo segue produzindo a hemoglobina A em doses suficientes.
Indivíduos nessa situação têm o chamado traço falciforme (um cópia normal do gene e outra alterada). Embora não seja uma doença, conhecer essa situação é importante porque, se essa pessoa se relacionar com outra que também carregue o traço (ou possua anemia falciforme), há risco de um filho manifestar a doença.
Para colocar em números, há um risco de 25% de a criança nascer com anemia falciforme caso ambos os pais tenham um gene alterado. Entre 2020 e 2022, foram registrados, em todo o país, mais de 177 mil casos de traço falciforme, de acordo com o Ministério da Saúde.
Estima-se que a alteração genética ligada à condição é fruto de uma mutação ocorrida há milhares de anos, principalmente no continente africano, o que explica a maior incidência entre a população negra. Isso porque essa mutação por trás da anemia falciforme também reduz o risco de infecção por malária, causada pelo parasita Plasmodiun falciparum.
Ou seja, muito tempo atrás, carregar esses genes poderia trazer uma vantagem evolutiva em locais onde a malária era comum. Mas em um mundo onde essa infecção é bem menos prevalente do que no passado, essa vantagem se esvai.
+ Leia também: A revolução do CRISPR está chegando ao Brasil
Quais são os sintomas de anemia falciforme?
Os danos da doença falciforme se estendem pelo corpo todo. Geralmente, os sinais surgem durante o primeiro ano de vida, por volta dos 5 meses. Entre eles, dá para destacar:
- Crises de dor, que atingem principalmente ossos, músculos e articulações, devido à redução do fluxo de sangue.
- Palidez e cansaço excessivo, pela queda na oxigenação.
- Icterícia, aquela coloração amarelada do branco dos olhos, por causa do aumento da bilirrubina no sistema circulatório, liberado durante a destruição dos glóbulos vermelhos.
- Inflamação nos tecidos que revestem os ossos dos tornozelos, punhos, e dos dedos, chamada síndrome mão-pé
- Principalmente crianças de até 5 anos podem sofrer retenção de um grande volume de sangue no interior do baço, levando ao quadro de crise de sequestração esplênica, uma urgência médica que é fatal quando não tratada.
- Risco aumentado de infecções.
- Danos nos rins e nos olhos.
- Acidente vascular cerebral (AVC).
- Atraso no desenvolvimento.
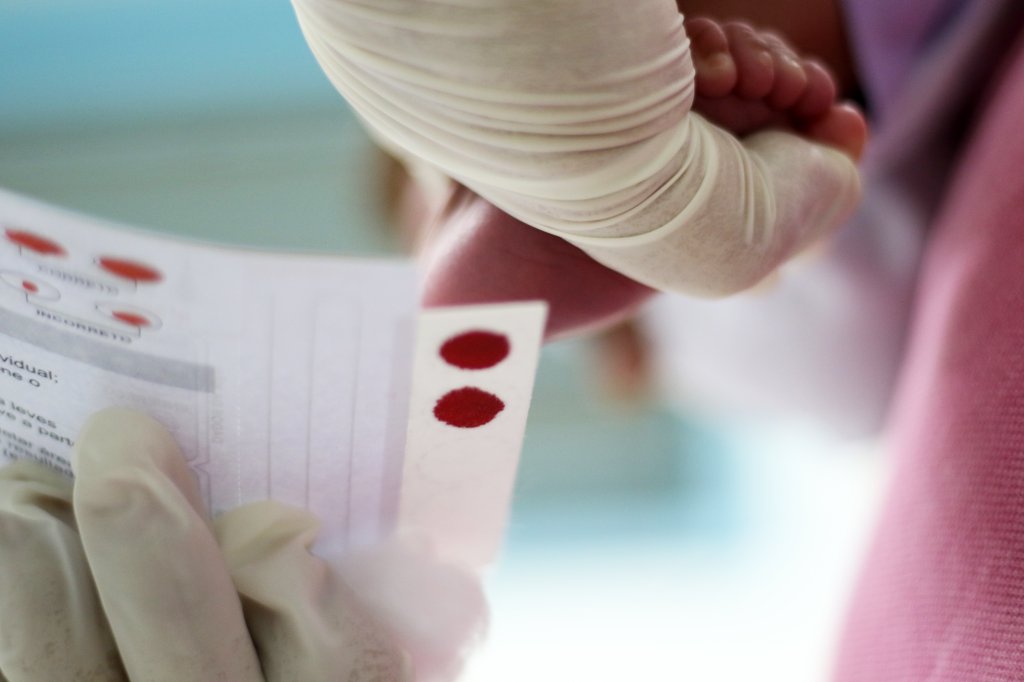
Como descobrir a anemia falciforme (diagnóstico)
A detecção pode ser realizada a partir de exame de sangue, logo após o nascimento, na rotina de triagem neonatal. A anemia falciforme é uma das doenças que podem ser identificadas pelo teste do pezinho, feito a partir de amostra do sangue coletado do calcanhar do bebê.
O Brasil conta com cerca de 30 serviços de referência habilitados pelo Ministério da Saúde, além da oferta de acompanhamento ambulatorial em mais de 140 unidades em todas as regiões.
O médico hematologista Celso Arrais, do Hospital Nove de Julho, explica que a doença também pode ser identificada posteriormente. “Em crianças com hemograma alterada e sintomas sugestivos, o diagnóstico é feito por meio de um exame de sangue chamado eletroforese de hemoglobina”, diz Arrais.
Esse método identifica a presença de versões anormais dessa proteínas – as tais hemoglobinas S – no sangue.
Algumas pessoas com anemia falciforme também exibem outras doenças que atingem a hemoglobina simultaneamente, como a talassemia. Essa enfermidade é diagnosticada pelo mesmo procedimento.
“A detecção precoce é crucial, porque permite um tratamento que ajuda a prevenir das complicações graves”, destaca o especialista.
Leia também: Anemia: o que é, sintomas, causas e como combater
O tratamento atual da anemia falciforme
Hoje, o cuidado se concentra na prevenção e no controle de episódios de dor e outras manifestações.
As estratégias incluem, por exemplo, a adoção de comportamentos para evitar a ocorrência de crises. Nesse sentido, vale beber bastante água, evitar extremos de temperatura, expor-se a grandes altitudes e praticar exercícios de alta intensidade (que acabam demandando muito oxigênio).
Certos medicamentos também são importantes. A inclui: ácido fólico, analgésicos, anti-inflamatórios, antibióticos (para o caso de infecções bacterianas oportunistas) e hidroxiureia (composto que diminui as crises ocasionadas pela obstrução dos vasos sanguíneos). Todos estão disponíveis gratuitamente no SUS, vale destacar.
“O único tratamento potencialmente curativo é o transplante de células-tronco hematopoiéticas, que pode ser indicado precocemente quando a criança começa a apresentar sinais de lesão em órgãos”, afirma Arrais. “Mas há indicações específicas e importantes limitações técnicas”, completa.
Desde 2015, o SUS faz esse transplante para pessoas com doença falciforme. Em 2018, o Ministério da Saúde ampliou a faixa etária para indicação de transplante. Antes era só para menores de 16, agora idade não é mais critério de restrição.
Ainda assim, há espaço para melhorias no campo da inovação. E as aprovações recentes das tecnologias de CRISPR fora do país são um incentivo e tanto nesse contexto.
O CRISPR basicamente consegue cortar trechos específicos do DNA e, se for o caso, adicionar outros trechos livres de mutações que causam doença. Ela se encaixa dentro das chamadas terapias gênicas, que interferem no nosso código genético.
Nos Estados Unidos, a FDA aprovou duas terapias gênicas para a anemia falciforme: Casgevy e Lyfgenia, sinalizando um avanço significativo na área. São as primeiras terapias genéticas para a doença falciforme em pacientes com 12 anos ou mais.
“O Casgevy é o primeiro produto de terapia que utiliza a ferramenta de edição gênica. Você tem a capacidade de utilizar uma cópia que já existe no seu genoma e fazer alguma modificação. É um grande marco dessa área”, afirma o cientista Ricardo Weinlich, pesquisador sênior do Hospital Israelita Albert Einstein.
Reduzir as crises recorrentes de obstrução dos vasos é o objetivo principal de Casgevy. Para isso, células-tronco hematopoiéticas, que geram as hemácias, são extraídas do próprio paciente e modificadas pela edição do genoma com o CRISPR.
Aí, são transplantadas de volta para ele, onde se fixam e se multiplicam na medula óssea, o que aumenta a produção de um tipo de hemoglobina que facilita o fornecimento de oxigênio.
A outra tecnologia, Lyfgenia, usa um vetor para entregar genes modificados dentro da célula da pessoa. A partir daí, as células do sangue são alteradas para produzir uma hemoglobina que funciona de forma semelhante à hemoglobina A, chamada HbAT87Q. Com a presença dela, os glóbulos vermelhos apresentam menor risco de deformação e bloqueio do fluxo sanguíneo.
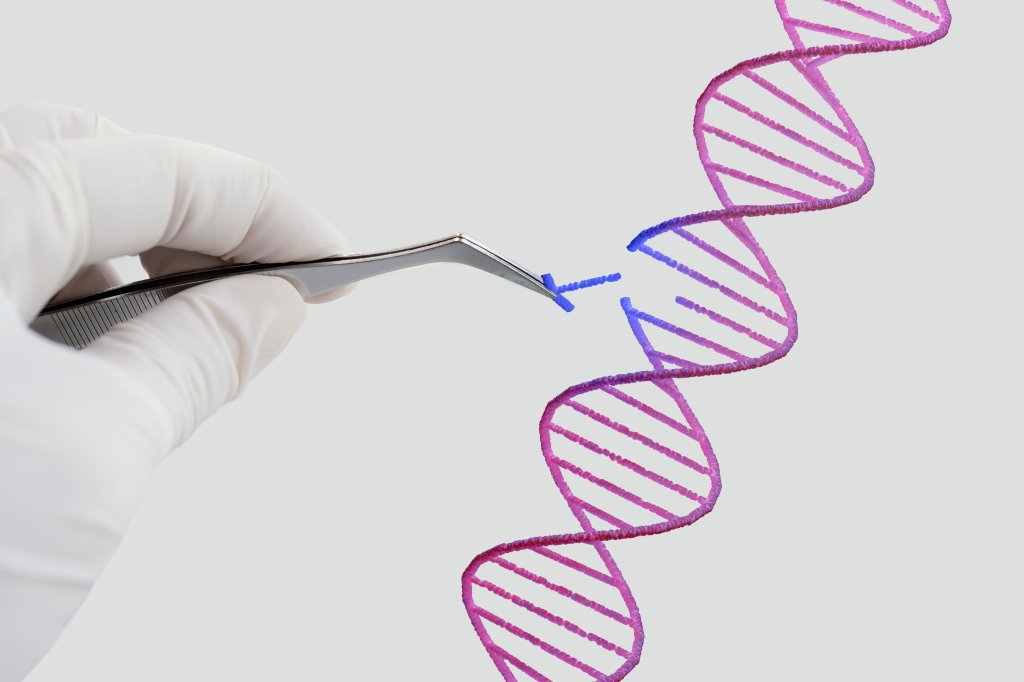
Perspectivas genéticas na anemia falciforme
As pesquisas que investigam maneiras de corrigir a mutação associada à anemia falciforme se concentram em variações das metodologias aprovadas nos Estados Unidos.
Ou seja, a ideia é trabalhar diretamente sobre o DNA de células-tronco do paciente. O passo a passo envolve a coleta, modificação genética e reintrodução no indivíduo.
A boa notícia é que o Brasil não fica de fora dessa corrida científica. O Hospital Israelita Albert Einstein, por exemplo, conduz um projeto na área por meio do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (Proadi-SUS).
A iniciativa busca aprimorar a técnica de terapia gênica para desenvolver um tratamento capaz de interromper a progressão da doença, aumentar a expectativa de vida e diminuir custos relacionados ao manejo das complicações.
O pesquisador Ricardo Weinlich, líder do grupo de terapia gênica, afirma que o objetivo central é elaborar um protocolo para uso no SUS. Para isso, estão em andamento duas linhas de pesquisa.
“A primeira é usar o sistema CRISPR tradicional para alterar e corrigir o defeito da beta-globina [uma parte da hemoglobina A]“, afirma Weinlich.
Os resultados até agora são animadores. “Conseguimos avançar bastante na fase de desenvolvimento nos laboratórios e encontrar um protocolo eficiente nessa correção. Agora, estamos olhando para a segurança e a qualidade”, pontua.
Em paralelo, o time do Einstein busca maneiras de dar escala para essa técnica. “Pretendemos conseguir editar, de uma vez só, até 300 milhões de células, a quantidade necessária para tratar um paciente”, acrescenta o especialista.
A segunda abordagem estudada consiste em um sistema semelhante ao da Casgevy, mas utilizando uma tecnologia de segunda geração da família do CRISPR, chamada editor de base. “É uma ferramenta mais eficiente, segura e barata, que foi desenvolvida alguns anos após a descoberta do CRISPR, e que se mostra ainda mais promissora”, explica o cientista.
Troca de conhecimento
Pesquisadores brasileiros também integram o Innovative Genomics Institute (IGI), sediado na Califórnia, nos Estados Unidos, em uma colaboração visando a troca de experiências.
Entre eles, está o médico Bruno Solano, coordenador do Centro de Biotecnologia e Terapia Celular (CBTC) do Instituto D’Or de Pesquisa e Ensino (IDOR), que estuda o CRISPR no tratamento da doença falciforme.
“Foi tudo muito rápido. É uma terapia alvo-específico que mal saiu da bancada e já está sendo testada em tratamentos clínicos para o HIV, câncer e doenças das hemoglobinas”, diz.
O pesquisador Eduardo Rego, também do IDOR, destaca que a terapia gênica é uma das áreas prioritárias do centro de pesquisa. Neste momento, os cientistas estudam uma tecnologia baseada em CRISPR com o objetivo de estimular a produção da hemoglobina fetal.
“O aumento da hemoglobina fetal faz com que haja menor falcização [deformação] das hemácias com hemoglobina S. Assim, diminuem muito as manifestações clínicas da anemia falciforme”, detalha.
O projeto está em fase adiantada, com perspectiva de parceria entre o IDOR e o IGI para a realização do primeiro estudo clínico, que pode começar já em 2024.
 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO


















